编者按:基于“AI for Science”新范式,启明创投投资企业深势科技专注于利用人工智能和分子模拟相融合的先进计算手段驱动难成药靶点的药物开发。近日,深势科技提名潜在best-in-class高选择性Kv1.3小分子抑制剂DPT0218作为治疗炎症性肠病和特应性皮炎等多种免疫疾病的临床前候选化合物。DPT0218已在数种自身免疫性疾病的临床前动物模型中展示出优越的效果。
深势科技创始人兼首席执行官孙伟杰在接受医药魔方Pro采访时,指出AI能突破很多药物研发场景的计算效率、准确性和能力的边界。谈及AI制药技术的商业切入点和价值主张,孙伟杰表示,AI制药注重提升原始创新的投入产出比,为行业解决更多关键而困难的问题。他亦分享了深势科技选择软件模式进行商业化的原因,即这种模式能让先进的技术最大程度和最快速度得到验证和反馈。展望AI制药的未来,他相信计算技术有望成为所有药物研发领域默认必备的基础设施。
启明创投微信公众号经授权转载。

深势科技创始人兼首席执行官孙伟杰
人工智能(AI)技术被寄予了变革新药研发的厚望。刚刚过去的2023年,AI制药领域保持良好的发展势头,一方面,BMS、诺和诺德、默克、赛诺菲、罗氏、AZ、艾伯维、礼来等10多家制药巨头继续关注AI制药,另一方面,资本寒冬下,全球AI制药领域依然累计收获了超26亿美元的融资。
应用层面,AI制药不断拓宽边界,除了传统小分子、大分子,在蛋白降解剂、细胞疗法、RNA疗法、肿瘤疫苗、基因编辑疗法等领域也逐渐释放潜力。此外,大模型、生成式AI等技术的突破也为AI制药领域的发展带来了新机遇。
目前火热的大模型究竟能给AI制药带来怎样的突破?AI制药产业近期发展态势如何?背后有哪些原因?在商业模式方面,AI制药公司有哪些选择?AI制药真正取得成功的标志是什么?近日,医药魔方Pro就这些问题采访了深势科技创始人兼首席执行官孙伟杰。
成立五年多的深势科技,致力于运用AI for Science的科研新范式,赋能生物医药等多领域的发展。2023年,深势科技完成了超7亿元人民币的最新融资,成为国内唯一入选2023年全球AI制药融资TOP10榜单的企业。除此之外,过去一年,深势科技对外合作不断,一年内与启明创投投资企业英矽智能,以及和径医药、晶泰科技、沙砾生物、维亚生物、美迪西、佰君生物等多家公司达成了合作。
值得注意的是,1月30日,深势科技药物研发团队宣布提名一款靶向Kv1.3的口服高选择性小分子抑制剂DPT0218为临床前候选化合物,用于治疗多种免疫性疾病,包括炎症性肠病和特应性皮炎等。2022年6月,制药巨头礼来曾以6000万美元首付款(潜在交易总额5.35亿美元)从D. E. Shaw Research(DESRES)公司获得一款Kv1.3抑制剂(DES-7114)的全球临床开发和商业化权利。
技术方面,2023年,深势科技发布了一系列重磅成果,对AI for Science基础设施进行了迭代升级,也将AI for Science带入了预训练大模型时代。
孙伟杰表示:“制药行业复苏的过程中,AI其实是一个重要的驱动力,有很多跨国企业、制药企业、Biotech企业都深度布局了AI技术,越来越多的人开始相信或者更加相信AI的力量。相信在不远的将来,计算技术将成为所有药物研发领域默认必备的基础设施。当大家不再需要强调AI这个概念,当AI成为药物研发中一个自然且不可或缺的部分时,AI制药就真正成功了。”

01/
AI是制药行业复苏的驱动力
医药魔方Pro:从CADD到AIDD,变化是什么?为什么AI可以为药物研发带来助力?
孙伟杰:过去几年大家对这两个概念难免争论,也给行业带来了不少热度。跳出概念本身的束缚的话,我们其实可以更关注技术发展的实质。从广义概念上来讲,CADD包含AIDD,AI其实是计算手段中的一种;也可以说CADD作为一种“泛智能”的工具,属于广义的AI的一部分。从狭义来讲,以机器学习为代表的AI技术,本质上使我们对高维复杂问题的处理能力有了大幅度提升,比如对于复杂物理模型和复杂科学数据的处理。由此,我们才有能力基于有限的数据攻克科学问题和工业研发问题。现在一系列的预训练大模型技术也给数据驱动和物理驱动的方法带来了更多、更强大的生产力工具。
具体到从CADD到AIDD的变化,CADD主要依赖于基于物理、化学和规则的计算方法,这些方法在处理复杂的化学和生物学时常常陷入效率和精度的两难问题。而AIDD则利用了深度学习、预训练模型等AI技术,突破了很多药物研发场景的计算效率、准确性和能力边界。
首先,在处理物理驱动的问题方面,AI能够高效拟合和加速量子力学、密度泛函、分子动力学等物理模型,更有效地模拟和理解生物分子复杂的结构、动力学和相互作用机制,发现过去未被发现的化学和分子生物学机理;其次,在处理数据驱动的问题时,如AlphaFold2和Uni-Mol所展示的,AI能够大幅提升信号挖掘和规律发现的效率,比如通过分析海量的生物学数据,发现之前未被理解或认识到的生物规律,或者基于预训练模型技术大幅提升对有限的实验数据的利用能力,以及对于ADMET等分子性质的预测能力;最后,对于传统意义上经验驱动的问题,如有机合成规则和经验打分函数,AI能够通过知识嵌入等手段,将物理规律、大数据和经验规则有机整合统一,为科学家的研发提供更多维的指导。
医药魔方Pro:过去几年,AI制药领域不管是资本市场表现,还是管线推进,都经历了起起伏伏,背后有哪些原因?
孙伟杰:广义的AI制药是指以计算手段为代表的药物研发方法,其实在过去二三十年中,AI已经逐渐渗透到了很多管线研发中。诚然,过去两年整个制药行业在一个相对来说的“寒冬”、“低谷”,AI制药领域的发展也在全行业的背景下深受影响。背后的原因有很多,我认为行业的起伏,一方面源于新技术的巨大机遇与技术成熟度相对不足之间的矛盾;另一方面,也源于“泡沫”之下额外资源和注意力的注入,当然也有很多非理性玩家涌入给行业带来的“噪音”。
当前AI制药技术的成熟度相较于人们过高的预期尚有差距。DeepMind的首席执行官Hasabis曾预测,我们想要实现“AI制药”的愿景大概还需要6个AlphaFold级别的技术突破。我的看法也是类似的,当前的很多AI技术突破已经在文献知识挖掘、蛋白质结构预测、蛋白动力学分析、蛋白-分子相互作用预测、分子ADMET性质预测等药物研发关键问题上提供新的解决方案,但实际上我们才刚刚抵达AI制药技术矿山的门口,底层的技术富矿还有极大空间等着我们挖掘。
人们对于AI技术的高度期望给行业带来了额外的资源和注意力,使得大家也更容易对行业任何的正面或负面的风吹草动有着“过度放大”的倾向。比如原本特定阶段的管线开发的成功率是2%,AI制药可以把成功率提升十倍至20%,但就特定的管线而言,仍旧有80%的概率是失败的。从药物研发的行业视角这是非常正常的事情,而往往大家比较有针对性地把“AI药物管线”的失败案例放大了。就像我前面所说,其实CADD作为广义的“AI制药”方法,已经几乎融入了所有主流组织的药物管线研发中,并为当前的药物研发行业提供了难以取代的价值。
总体上还是要理性地看待整个技术发展的生命周期,前沿技术必须经过“泡沫”的催化才能获得充足的资源,才能获得快速的发展。进入现代社会以来,我们高新科技产业也是在一轮一轮的“泡沫”浪潮中螺旋上升的,而浪潮的暂时褪去对行业也是好事。
过去几年的行业起伏正在给AI制药带来更多的机会,因为这种低谷和震荡本质上是行业出清、良币驱逐劣币的过程;更是倒逼创新效能提升,促进创新技术快速应用于行业研发的过程;也是促进AI制药组织与药物研发组织彼此拨云见日,不断凝练真问题的过程。我们也看到,在这个过程中有越来越多的跨国企业、Biotech、创业公司都深度布局和全面拥抱AI技术,越来越多的人相信或者更加相信AI的力量。相信在AI制药逐步克服上述的一些挑战后,将会为行业带来越来越多的高价值产出,也将成为行业复苏更强大的内在动力。
医药魔方Pro:AI制药行业近期的发展势头如何?背后有哪些深层次的原因?
孙伟杰:AI制药行业正在快速发展,且这种发展一直是连续的、持续的,这既有内生(技术创新)的原因,也有环境的原因。比如全球开放科学体系的协同推动,市场和投资人对于AI制药行业认知的不断深化,以及头部企业的研发实践带来越来越多的成功案例的出现,都在作用于行业的积极演变。关于行业变化前面已经讨论了不少,这里重点说说技术的变化,尤其是AI制药的底层技术基座——AI for Science。
AI for Science在过去两年刚刚迈入预训练模型时代,整体上相比于以GPT为代表的大语言模型,技术发展周期大约滞后3-4年。但就像前文所说,AI for Science底层技术的发展已经为行业带来了很多质的变化。
比如对于大家始终无法回避的,老生常谈的数据质量和可用性问题,与语言、图片处理等数字世界的数据问题不同,药物研发行业在AI的视角下,可能“数据不足”不是一个结论,甚至不是问题本身,而是我们讨论问题的起点。由于真实的化学、生物空间往往庞大到我们无法想象也很难在实验层面可及的地步,我们可能永远无法基于现有的实验手段获得真正的“大数据”,因此基于AI对整个化学和生物空间的表征和采样就显得尤为重要。这也是Uni-Mol、Uni-RNA等AI for Science大模型将会带给行业的巨大变化,和致力于完成的工作。
AI算法和工具的验证体系也正在快速健全的过程中。相比于数据,验证体系可能是AI技术发展更重要的方面。在过去几年中,随着生物技术的发展,AI与制药、Biotech、CRO企业合作数量的增多,已经基本上在AI算法关注的各个药物研发环节上摸索出干湿闭环的验证体系,而不像是更早时期的“闭门造车”。
时至今日,我们已经能够清晰地意识到Hasabis所说的,行业需要的6个突破已经有3-4个都在现有的技术储备中快速生长了,并且成长的土壤越来越肥沃,只要给这种前沿技术的发展更多时间和耐心,假以时日必将给行业带来更多惊喜。
在技术快速发展的前提下,AI制药技术的商业切入点和价值主张也在变得更加明确。药物研发更多是一种原始创新投入,这种投入很反常识,当它的投入产出比提升时,人们不仅不会为了“省钱”而选择用更少的投入完成跟原来一样的研发工作,反而会投入更多的资源来挖掘更多“宝矿”。因此AI制药要做的,不只是效率的提升,更重要的是效能提升;效率提升更多是成本视角,而效能提升是投入产出比视角,是如何提升原始创新的投入产出比,让大家的创新有的放矢,为行业解决更多问题。
前沿技术的发展到落地不是一劳永逸的逻辑,而更像是“沿途下蛋”的逻辑。我们不能期望AI在当下能够解决所有问题,但在不同的AI技术成长阶段,需要以当前的技术能力边界为限,优先解决最关键而困难的问题,而不是在低水平上加剧内卷。我们意识到,给行业带来更大价值的主要有两个方面,一是难成药靶点的开发,比如针对IDP(固有无序蛋白)、GPCR/离子通道等膜蛋白、PPI的药物发现;二是针对成熟靶点的差异化开发,尤其是复杂的分子设计问题,比如特殊的PK/PD profile的分子设计、多靶点抑制剂、ADC等组合型药物设计等。这两类工作能够显著体现AI相比于传统药物设计思路的优越性,也是最能够给行业带来突破性的研发价值的方向。
最近,我们的药物研发团队刚刚提名一款靶向Kv1.3的口服高选择性小分子抑制剂DPT0218为临床前候选化合物。DPT0218的发现依托了深势科技的RiDYMO®药物研发平台,其融合了多种AI及物理模型算法(核心算法之一的强化动力学算法Reinforced Dynamics在分子模拟采样效率上具有显著优势,通过充分结合神经网络的高维表示能力,Reinforced Dynamics能够在复杂的生物大分子体系中高效地捕捉动态构象变化),致力于“难成药”靶点及best-in-class分子的药物开发。离子通道的动力学过程极其复杂,RiDYMO®平台无疑正适合应用于这一系列高难度体系的药物开发。DPT0218的成功发现是达成AI for Science愿景的重要一步。我们期待与该领域经验丰富的药企建立合作关系,共同推动这个项目进入下一个里程碑。
02/
AI制药迈向“预训练大模型时代”
医药魔方Pro:为什么深势科技要强调AI与物理模型融合?
孙伟杰:因为我们的客观世界本身是物理的,药物也不例外地遵守物理规律的约束。纯粹的数据驱动方法在缺乏足够高质量数据时可能效果有限,而物理模型能够提供必要的理论基础、结构框架和数学约束,大幅降低我们对于数据的需求,提升模型的精度和泛化能力。
医药魔方Pro:目前火热的预训练大模型在AIDD中有哪些应用?
孙伟杰:预训练是先对自变量进行学习,使得模型对于自变量空间结构学习到足够的知识,然后再使用有标签的数据进行二次训练(finetune)的方法。一般来说,预训练学习所需的自变量数据十分充足,而标签数据相对稀缺(药物研发中的标签数据主要是各公司的私域实验数据),因此,预训练模型相比于传统的“小模型”可以彰显出巨大的优势。
举例来说,深势科技开发的Uni-RNA通过对大约20亿条高质量RNA序列的大规模预训练,充分挖掘了RNA序列中的潜在信息。这种大规模的预训练使得Uni-RNA能够在RNA结构预测、mRNA序列性质预测和RNA功能预测等关键领域取得领先的成果。
此外,深势科技开发的Uni-Mol 3D分子表征预训练模型,通过对数十亿个分子的三维结构的预训练,再结合实验数据的finetuning来驱动分子生成、小分子性质预测、大分子性质预测、小分子-蛋白结合性质等各类下游任务。在最近的更新中,Uni-Mol docking v2在蛋白-配体对接预测上取得了显著进步。它在最新的PoseBuster数据集上表现出超越AlphaFold-latest的精度,这对于发现和优化新药分子具有重要意义。
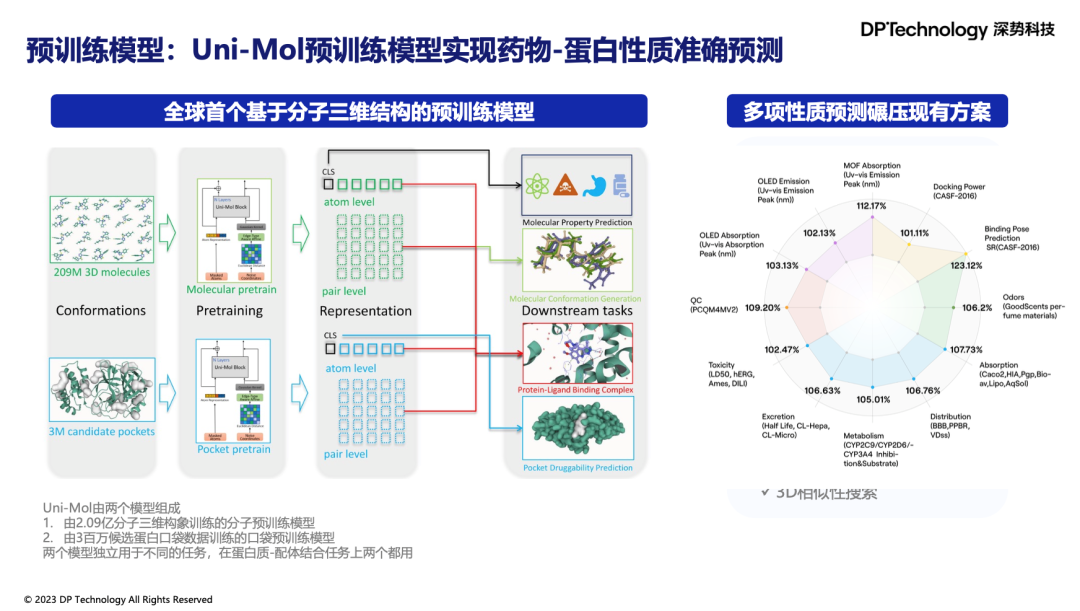
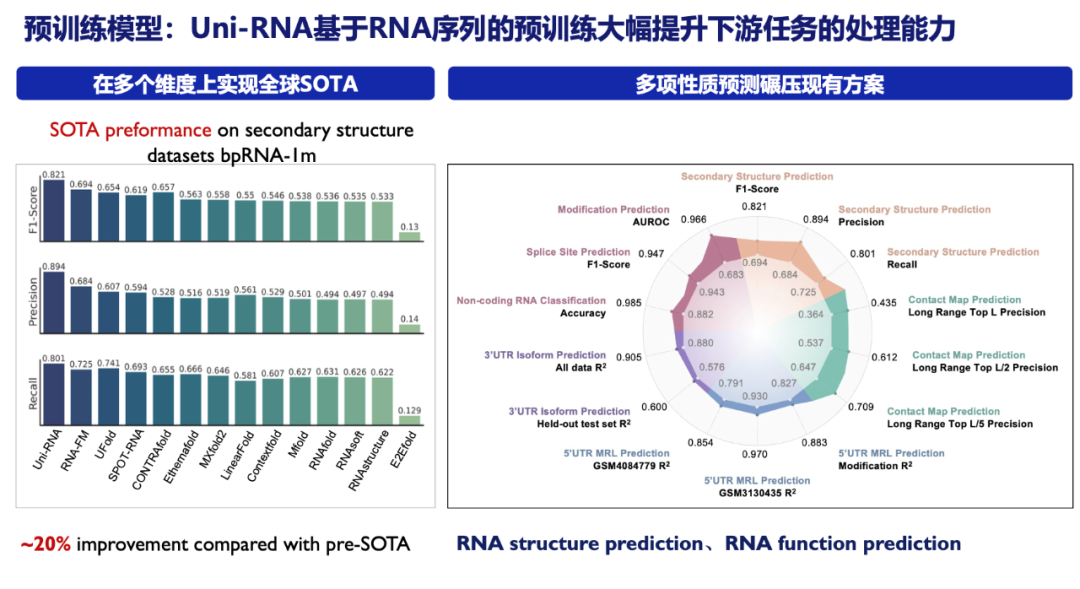
除了Uni-RNA、Uni-Mol这类AI for Science“大模型”,我们也广泛地探索了大语言模型在药物研发领域的潜力。药物研究人员需要阅读大量文献来分析特定靶点的关键作用区域,收集活性小分子的数据等。这一过程往往需要耗费大量的时间和人力资源。传统的科学文献数据库(如SciFinder)尽管提供了检索功能,却仍需要人工筛选并阅读大量文献。此外,尽管像ChatGPT这样的大型语言模型在处理自然语言方面表现出色,但面对含有分子结构图、化学反应式等多模态元素的科学文献时,它们却显得力不从心。
针对上述挑战,深势科技推出了智能科学文献数据库平台Uni-Finder,旨在进一步提升科学文献的阅读和分析效率。该平台不仅具备传统数据库(如SciFinder)的多模态检索功能,还能通过自然语言交互,在筛选结果中灵活且自动化地提取所需信息,如多个专利的共同中间体或与特定靶点相关的小分子活性数据。此外,由于其对科学多模态元素的精确理解,Uni-Finder在科学文献的内容理解和问答方面的性能也优于其他大型语言模型。
Uni-Finder的核心技术是深势科技自研的科学多模态大模型Uni-SMT(Universal Science Multimodal Transformer)。不同于之前仅关注纯文本的大型语言模型,Uni-SMT综合考虑了科学文献中的多模态元素,如图表、数学方程、分子结构和化学反应方程式等。它运用多模态对齐技术,实现了对科学文献的更全面和精确理解。例如,对于某些专利,Uni-SMT能够通过多模态对齐技术同时理解markush式(带有可变基团的化学分子式)和文本中对可变基团的描述,从而精确地识别和解析专利的保护范围。
03/
AI制药真正的成功是“淡化AI”
医药魔方Pro:AI制药公司的商业化模式备受关注,深势科技为何选择软件模式为主?
孙伟杰:对于一个行业的新技术而言,只要技术本身有用、能够解决问题,无论什么样的商业模式,它一定能够带来价值,只是价值的实现方式和规模不同。
软件模式能够让行业所有玩家都能快速使用最先进的技术,这种商业模式和载体,同时也能让先进的技术最大程度和最快的速度得到验证和反馈。而在提供软件服务的基础上,我们也和其他公司与机构做一些管线的联合开发和对外授权(license-out),帮助合作伙伴更好地开发高价值管线资产。
医药魔方Pro:您认为,AI制药成功的标志是什么?
孙伟杰:AI制药真正取得成功的标志,在于不再需要强调AI这个概念本身,而是将其作为药物研发中一个自然且不可或缺的部分。我们已经可以看到这种趋势的初步体现:Biotech创始人组合正在从传统的生物学家和药物化学家,转变为生物学家、药物化学家加上计算科学家的组合。相信在不远的将来,计算技术将成为所有药物研发领域默认必备的基础设施。
至于AI是否会取代人类,答案是否定的。AI不会取代人类,但会用AI的人很可能会取代那些不会用AI的人。从供给和需求的角度来看,新技术的出现总是伴随着对人类福祉的提升。AI在药物研发中的应用,将使得研发过程更加高效,推动新药的快速发现和开发,最终惠及整个人类社会。
来源 | 医药魔方Pro